

一、罗氏ALK抑制剂「阿来替尼」拟纳入突破性治疗品种
中国国家药品监督管理局药品审评中心(CDE)官网公示,罗氏(Roche)申请的盐酸阿来替尼胶囊拟纳入突破性治疗品种,拟定适应症为用于间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLC)患者的术后辅助治疗。
药物信息
药物名称:Alectinib Hydrochloride
适应症:肺癌
研发公司:罗氏
API结构
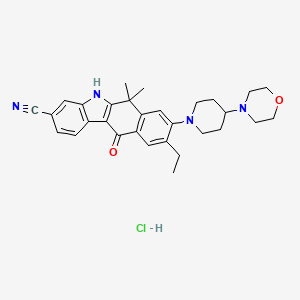
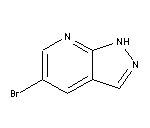
CAS:1256589-74-8
Alectinib Hydrochloride结构中韶远能够提供的小分子砌块
SY060670
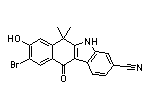
SY060669
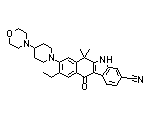
SY031541

二、48周减重35.6斤,国产「减肥神药」来了?
信达公布其与礼来共同推进的GLP-1R/GCGR双重激动剂玛仕度肽在中国肥胖受试者中的最新II期临床数据。
结果显示,在治疗48周后,玛仕度肽9mg组体重较基线的平均百分比变化与安慰剂组的治疗差值达−18.6%,平均变化值与安慰剂组的差值达−17.8kg;51.2%的受试者体重较基线下降15%以上,34.9%的受试者体重较基线下降20%以上。
以减重效果对比,玛仕度肽优于此前司美格鲁肽注射液在STEP1实验中的表现。
STEP1结果显示,经过68周治疗后,司美格鲁肽2.4mg组的体重降幅约为14.9%,安慰剂组为2.4%,两组间治疗差值为-12.5%。
与礼来的替尔泊肽注射液相比,玛仕度肽的减重效果接近替尔泊肽在SURMOUNT-1中的表现。
SURMOUNT-1结果显示,经过72周治疗后,替尔泊肽最高剂量15mg组的平均体重减轻约22.5%(23.6kg),安慰剂组减轻约2.4%(2.4kg),两组间治疗差值为-20.1%(-21.2kg)。
安全性方面,玛仕度肽9mg组在48周治疗期内无严重不良事件,无导致停药的不良事件;同时,其二步滴定给药方案相比之下更加简捷耐受。
药物信息
药物名称:GLP-1R
适应症:肥胖
研发公司:信达与礼来
API结构
CAS:281209-71-0
GLP-1R结构中韶远能够提供的小分子砌块
SY106809
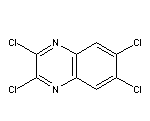
281211-09-4

三、上海医药拉考沙胺原料药上市申请获得批准
近日,上海医药下属全资子公司上药康丽(常州)药业有限公司收到国家药品监督管理局颁发的关于拉考沙胺原料药的《化学原料药上市申请批准通知书》(通知书编号:2023YS00679),该药物获得批准生产。
拉考沙胺原料药可用于注射液及口服溶液的生产,适用于4岁及以上癫痫患者部分性发作的联合治疗。最早由UCB Pharma SA研发,于2008年8月在欧洲市。2021年7月,上药康丽就该原料药向国家药监局提出上市申请并获受理;近日,上药康丽收到国家药监局下发的《化学原料药上市申请批准通知书》。该药物在 CDE原辅包登记信息平台上显示状态为“A”。
本次拉考沙胺原料药获得《化学原料药上市申请批准通知书》,表明该原料药符合国内药品注册的有关规定要求,可以在国内市场进行销售,同时为公司后续产品开展原料药申报积累了宝贵的经验。
药物信息
药物名称:Lacosamide
适应症:癫痫
研发公司:上药康丽
API结构
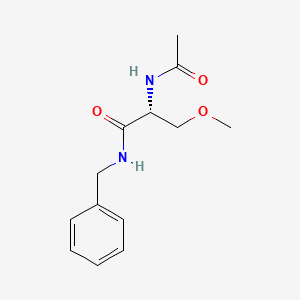
CAS:175481-36-4
Lacosamide结构中韶远能够提供的小分子砌块
SY110724
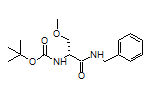
474534-78-6
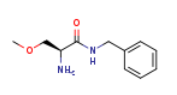
四、AceLink宣布AL01211法布雷病2期临床试验完成首例受试者首次给药
BioBAY园内企业AceLink Therapeutics(以下简称AceLink)宣布其在研的治疗法布雷病的新药AL01211,已在国内完成了2期临床的首例患者首次给药。
AL01211是一种新型口服非脑渗透性葡萄糖神经酰胺合酶(GCS)抑制剂,目前正在开发用于治疗鞘糖脂贮积类疾病,包括法布雷病和1型戈谢病。在1期临床试验中,AL01211总体耐受性良好,未出现严重不良事件。
该项2期开放性临床试验正在评估AL01211在既往未经治疗的经典型法布雷病男性患者中的安全性、药代动力学和药效学。AceLink计划在中国6个研究中心招募18名患者。上海瑞金医院的陈楠教授是牵头这项工作的主要研究者(PI)。公司预期2024年下半年获得此临床试验的初步结果。
药物信息
药物名称:AL01211
适应症:鞘糖脂贮积
研发公司:AceLink Therapeutics
API结构
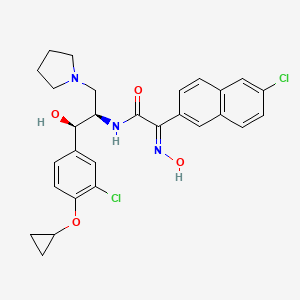
CAS:Null
AL01211结构中韶远能够提供的小分子砌块
SY277608
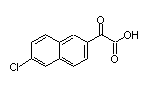
SY277092
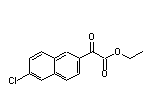
SY277287
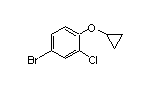
SY020999
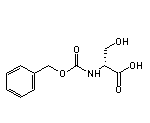
五、总缓解率达67%!创新激酶抑制剂获FDA授予优先审评资格
Day One Biopharmaceuticals日前宣布美国FDA接受tovorafenib新药申请(NDA)。该药物正被开发为单药疗法,用于治疗复发性或进展性儿童低度恶性胶质瘤(pLGG)。值得注意的是,美国FDA已授予该申请优先审评资格,并设定PDUFA目标日期为2024年4月30日。
药物信息
药物名称:Tovorafenib
适应症:儿童低度恶性胶质瘤
研发公司:Day One Biopharmaceuticals
API结构
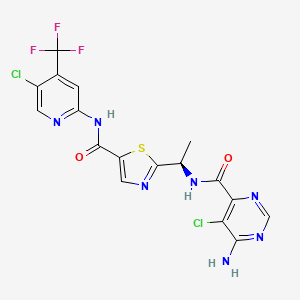
CAS:1096708-71-2
Tovorafenib结构中韶远能够提供的小分子砌块
SY109242
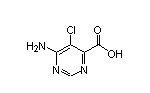
SY355231
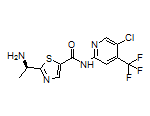
SY355545
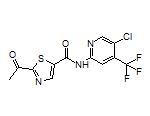
六、【2023 ASH】六连冠!耐立克携多项研究第六次入选,其中2项获口头报告
致力于在肿瘤、乙肝及与衰老相关疾病等治疗领域开发创新药物的领先的生物医药企业——亚盛医药(6855.HK)宣布,公司原创1类新药奥雷巴替尼(商品名:耐立克)有多项临床进展获选第65届美国血液学会(American Society of Hematology,ASH)年会,其中2项获口头报告。这是该品种的临床进展连续第6年入选ASH年会口头报告,充分体现国际血液学界对其疗效和安全性的认可。值得一提的是,今年,亚盛医药2个在研新药(耐立克、APG-2575)有多项临床研究入选ASH年会展示及报告。
耐立克是亚盛医药自主研发的全球层面best-in-class药物,在多种实体瘤和血液肿瘤治疗领域具有广阔潜力。该品种在中国的商业化推广由亚盛医药和信达生物共同负责。公司将在此次ASH年会上,口头报告该品种治疗一代和二代酪氨酸激酶抑制剂(TKI)耐药的慢性髓细胞白血病慢性期(CML-CP)患者的随机对照注册性II期研究最新进展。该研究主要研究者为北京大学人民医院血液科黄晓军教授与江倩教授。研究数据显示,在既往TKIs耐药/不耐受的CML- CP患者中,与对照现有最佳疗法(BAT)治疗组相比,耐立克治疗组在无事件生存期(EFS)显示了统计学和临床上显著意义的改善,达到了本研究的主要研究终点。
药物信息
药物名称:Olverembatinib
适应症:肿瘤
研发公司:亚盛医药
API结构
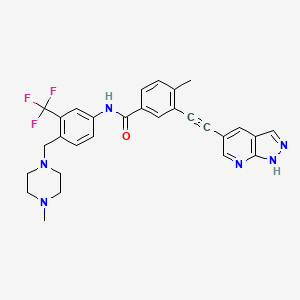
CAS:1257628-77-5
Olverembatinib结构中韶远能够提供的小分子砌块
SY012662
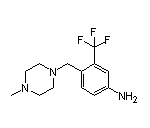
SY242501
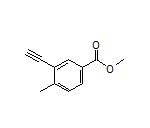
SY006972
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com
相关推荐
-


2024-01-06
韶远资讯 | 全球小分子药物研发前沿动态(总第114期)
-


2023-12-14
韶远资讯 | 全球小分子药物研发前沿动态(总第113期)
-


2023-12-07
韶远资讯 | 全球小分子药物研发前沿动态(总第112期)
-


2023-11-22
韶远资讯 | 全球小分子药物研发前沿动态(总第111期)
-


2023-11-08
韶远资讯 | 全球小分子药物研发前沿动态(总第110期)
-


2023-10-23
韶远资讯 | 全球小分子药物研发前沿动态(总第109期)
-


2023-10-08
韶远资讯 | 全球小分子药物研发前沿动态(总第108期)
-


2023-09-23
韶远资讯 | 全球小分子药物研发前沿动态(总第107期)




