

一、全球首个!诺华 BTK 抑制剂在国内报上市,治疗荨麻疹
近日,CDE 官网显示,诺华瑞米布替尼片(Remibrutinib)上市申请获受理。根据临床试验进展和诺华新闻稿,推测本次申报的适应症为慢性自发性荨麻疹(CSU)。这是国内首个寻求监管批准用于慢性荨麻疹的 BTK 抑制剂。
瑞米布替尼是一款靶向 BTK 的共价抑制剂,正在被开发用于治疗荨麻疹、多发性硬化症、化脓性汗腺炎、重症肌无力等适应症。2024 年 5 月,诺华公布了瑞米布替尼治疗慢性自发性荨麻疹的 III 期临床数据。在关键 III 期 REMIX-1 研究和 REMIX-2 研究中,瑞米布替尼治疗早期就表现出显著的症状改善,这种改善持续至第 52 周。
药物信息
药物名称:Remibrutinib
适应症:慢性自发性荨麻疹(CSU)
研发公司:诺华
API结构
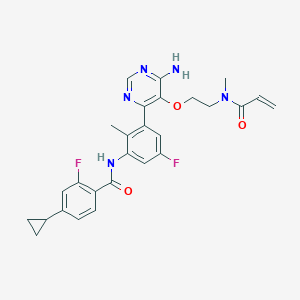
CAS:1787294-07-8
Remibrutinib结构中韶远能够提供的小分子砌块
SY003181
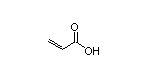
SY282951
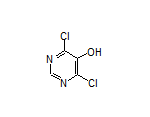
SY014347
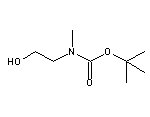
SY333370
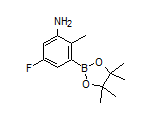
SY423008
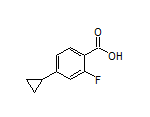
二、即将报上市!阿斯利康新一代口服 SERD 药物联用 CDK4/6 抑制剂 III 期成功
近日,阿斯利康宣布SERENA-6 III 期临床试验中,Camizestrant 在一线晚期 HR 阳性乳腺癌(伴 ESR1 肿瘤突变)患者中表现出高度统计学显著和临床意义的无进展生存期改善。具体数据将在即将召开的医学会议上公布并与全球监管机构共享。
新闻稿指出,Camizestrant 是首个且唯一一个新一代口服 SERD 和完全 ER 降解,与广受认可的 CDK4/6 抑制剂联合使用可在一线治疗中带来益处。
中期分析结果显示,Camizestrant 与 CDK4/6 抑制剂(哌柏西利、瑞波西利或阿贝西利)联合使用,在无进展生存期 (PFS) 这一主要终点方面表现出了具有高度统计学意义和临床意义的改善。关键次要终点 PFS2 和 OS 尚不成熟。然而,Camizestrant 联合用药已经显示出 PFS2 改善的趋势。
药物信息
药物名称:Camizestrant
适应症:一线晚期 HR 阳性乳腺癌无进展生存期改善
研发公司:阿斯利康
API结构
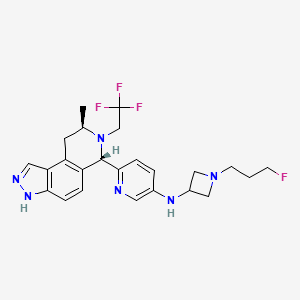
CAS:2222844-89-3
Camizestrant结构中韶远能够提供的小分子砌块
SY333630
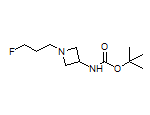
SY017232
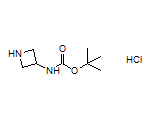
SY025148
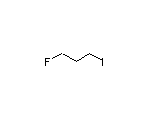
SY002971
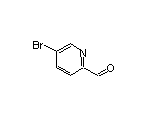
SY014864
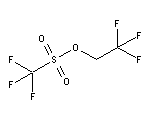
SY003799
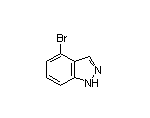
SY059669
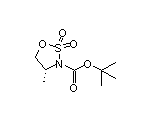
三、勃林格殷格翰突破性肺纤维化疗法上市申请提交,或成十年来首款!
近日,勃林格殷格翰宣布其研发的肺纤维化创新疗法口服磷酸二酯酶4B(PDE4B)抑制剂——Nerandomilast的上市申请已获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)的受理,用于治疗成人特发性肺纤维化(Idiopathic Pulmonary Fibrosis, IPF)。此前,该疗法已被CDE纳入优先审评审批程序,以期加速其在中国的上市进程。
Nerandomilast是一款在研的口服PDE4B抑制剂,正被开发作为IPF和进展性肺纤维化(PPF)的潜在治疗药物。Nerandomilast于2022年2月获得美国食品药品监督管理局(FDA)授予的IPF突破性疗法认定。
Nerandomilast的上市申请递交是基于其关键性III期临床试验FIBRONEER™-IPF的积极结果,这是十年来首个达到主要终点的IPF III期临床试验,标志着IPF治疗领域有望迎来下一代突破性疗法。
药物信息
药物名称:Nerandomilast
适应症:特发性肺纤维化
研发公司:勃林格殷格翰
API结构
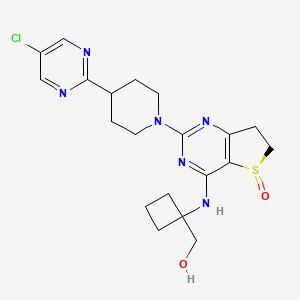
CAS:1423719-30-5
Nerandomilast结构中韶远能够提供的小分子砌块
SY098454
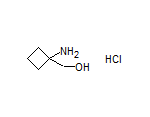
SY214038
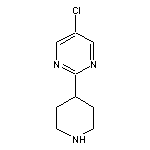
SY355337
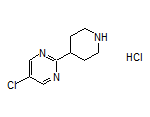
SY110550
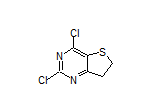
四、英派药业塞纳帕利胶囊(派舒宁®)获得中国国家药品监督管理局(NMPA)批准上市
近日,华岭资本投资企业--南京英派药业有限公司(以下简称“英派药业” )自主研发的塞纳帕利胶囊(商品名:派舒宁®)已获得国家药品监督管理局(NMPA)批准上市,塞纳帕利用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
塞纳帕利是由英派药业自主研发的新型、高效的PARP1/2抑制剂,具有独特的分子结构,使其具备体外和体内高活性,以及高靶向选择性和广泛的安全窗口。塞纳帕利的获批是基于FLAMES研究,该研究是一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床研究,旨在评价一线含铂化疗达到完全缓解(CR)或部分缓解(PR)后塞纳帕利单药维持治疗晚期卵巢癌患者的有效性和安全性。FLAMES研究结果显示,塞纳帕利维持治疗能够显著延长晚期卵巢癌患者的中位无进展生存期(mPFS)(未达到 vs 13.6月, HR 0.43, P < 0.0001),且不论患者的BRCA基因表达如何,均能从塞纳帕利治疗中获益。同时,塞纳帕利耐受性良好,安全性可控。1此外,塞纳帕利在具有同源重组缺陷(HRD)和同源重组修复正常(HRR)亚组的患者中均显示出显著PFS获益,突显其广泛的临床应用潜力。此研究结果将有力支持塞纳帕利单药作为新诊断卵巢癌患者一线全人群维持治疗的标准方案。
药物信息
药物名称:Senaparib
适应症:晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌
研发公司:英派药业
API结构
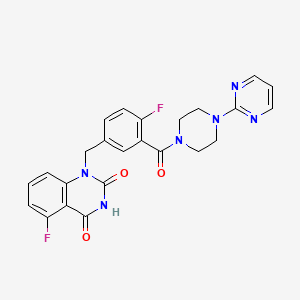
CAS:1401682-78-7
Senaparib结构中韶远能够提供的小分子砌块
SY002612
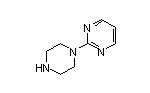
SY016922
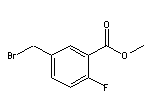
SY011009
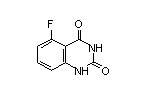
五、泽布替尼年入26亿美元!贡献百济神州69%营收
百济神州发布2024年业绩快报。快报显示,其核心产品泽布替尼(百悦泽)全球销售额已达到26亿美元(人民币188.59亿元),同比增长105%。
自2019年在美国首次获批上市以来,泽布替尼迅速占领市场并在全球各地扩大地盘。目前,该药已在全球70多个市场获批,包括中国、美国、德国、意大利、西班牙、法国、英国等地,累计全球销售额已超过47亿美元。
除了走全球化路线,泽布替尼还在不断拓展患者群体。作为全球获批适应症最广泛的BTK抑制剂,该药可用于慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(WM)、滤泡性淋巴瘤(FL)等多个瘤种。
尤其是在一线和复发/难治性CLL中的广泛使用,推动了泽布替尼在美国市场需求的大幅增长。CLL是成人白血病最常见的类型,约占白血病新发病例的三分之一。
百济神州在快报中表示,2024年总收入超38亿美元,同比增长55%,全年业绩再创历史新高。而这主要得益于泽布替尼在美国和欧洲的销售额分别同比增长106%和194%。
作为一款“重磅炸弹”,泽布替尼的产品收入对百济神州总收入的贡献,已从2020年的14%,提高到2024年的69.3%。
药物信息
药物名称:Zanubrutinib
适应症:肿瘤
研发公司:百济神州
API结构
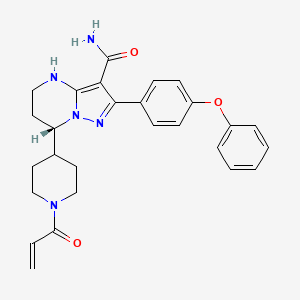
CAS:1691249-45-2
Zanubrutinib结构中韶远能够提供的小分子砌块
SY001081
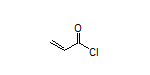
SY274128
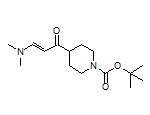
SY007085
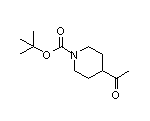
SY033527
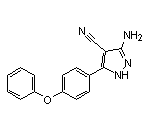
六、FDA已受理Chimerix为Dordaviprone递交的新药申请,用于治疗复发性H3 K27M突变弥漫性胶质瘤患者。
近日,Chimerix宣布FDA已受理该公司为Dordaviprone递交的新药申请,用于治疗复发性H3 K27M突变弥漫性胶质瘤患者。数据显示,在使用RANO 2.0进行评估时,Dordaviprone在H3 K27M突变弥漫性胶质瘤患者中达到28%的客观缓解率,中位缓解持续时间为10.4个月。
药物信息
药物名称:Dordaviprone
适应症:复发性H3 K27M突变弥漫性胶质瘤
研发公司:Chimerix
API结构
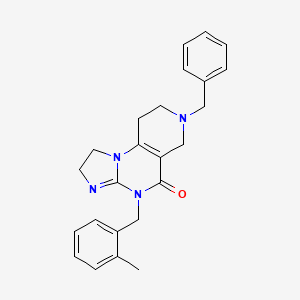
CAS:1616632-77-9
Dordaviprone结构中韶远能够提供的小分子砌块
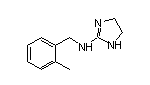
SY277951
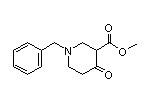
SY012808
素材来源:药渡、Pubchem,若有侵权望联系删除!
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com




