

一、欣必松®(两性霉素B脂质体)首张处方落地
欣必松®(注射用两性霉素B脂质体)在西安交通大学第一附属医院开出全国首张处方,正式迈入临床应用新阶段,为广大侵袭性真菌病患者带来治疗新选择。
近年来,随着广谱抗生素、抗肿瘤药物、免疫抑制剂等的广泛应用,以及造血干细胞移植、器官移植等技术的开展,侵袭性真菌病的发病率及死亡率呈明显上升趋势。研究显示[1],全球每年有超过 655 万人受到真菌疾病的影响,导致超过 375 万人死亡,其中约 255 万人的死亡可直接归因于真菌疾病,给临床带来巨大挑战。
现阶段,抗真菌药物中三唑类、棘白菌素类,抗菌谱相对窄且容易出现耐药;另外,普通两性霉素B(AmB-D),肾毒性高且容易出现输注反应,都未能充分满足临床需求。面对当前耐药真菌、少见/罕见真菌的感染挑战,亟需新型抗真菌治疗方案,帮助患者渡过难关。
其中,两性霉素B脂质体(L-AmB)凭借革命性脂质体包裹技术,精准输送药物至感染组织部位,游离药物释放减少,突破性实现高效杀菌与安全性双提升。研究显示[2][3]:L-AmB因脂质体体积小,较少被肾脏过滤,避免AmB与远端小管细胞的相互作用,明显改善肾毒性;同时因能降低促炎细胞因子的上调,进而减弱输液反应。作为一款高效低毒的抗真菌利器,可为临床医生提供更优选择。
药物信息
药物名称:Amphotericin B
适应症:侵袭性真菌感染
研发公司:济民可信
API结构
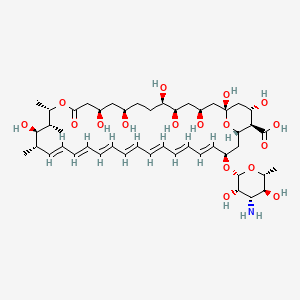
CAS:1397-89-3
Amphotericin B结构中韶远能够提供的小分子砌块
SY060712
二、【大咖点评·例证肺凡】舒沃替尼二线治疗PFS超17个月,为EGFR exon20ins突变NSCLC高龄患者保驾护航
在非小细胞肺癌(NSCLC)中,EGFR 20号外显子插入突变(EGFR exon20ins)是区别于EGFR经典突变的原发独立的驱动基因。中国NSCLC患者中EGFR exon20ins发生率约为2.1%~2.24%,仅次于EGFR经典突变。与EGFR经典突变患者不同,大多数EGFR exon20ins突变患者对1~3代EGFR-TKI治疗疗效欠佳,亟需更有效更精准的靶向药。舒沃替尼是我国自主研发的一款新型口服、不可逆抑制的高选择性EGFR-TKI,可靶向包括EGFR exon20ins突变在内的多种EGFR突变亚型,是中国首个同时获得国家药监局NMPA和美国FDA突破性疗法认定的治疗EGFR exon20ins突变型NSCLC的1类创新药。舒沃替尼中国注册研究“悟空6”(WU-KONG6)结果显示,二/后线治疗的客观缓解率(ORR)达61%,疾病控制率(DCR)达88%。目前,舒沃替尼已在我国正式获批用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗的EGFR exon20ins突变NSCLC,并作为《国家基本医疗保险、工伤保险和生育保险药品目录(2024年)》[7]医保报销药物,为我国EGFR exon20ins突变NSCLC患者提供了高效且可及的治疗选择。
药物信息
药物名称:Sunvozertinib
适应症:非小细胞肺癌
研发公司:迪哲医药
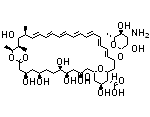
API结构
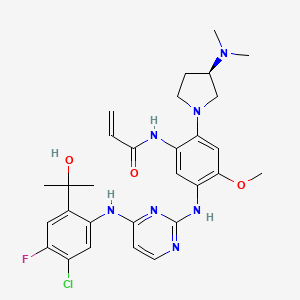
CAS:2370013-12-8
Sunvozertinib结构中韶远能够提供的小分子砌块
SY001081
SY002287
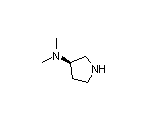
SY060358
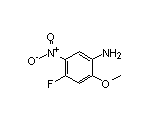
SY300679
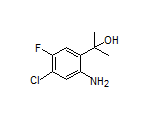
SY001677
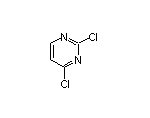
三、恒瑞医药硫酸阿托品滴眼液上市申请获受理
近日,恒瑞医药子公司成都盛迪医药有限公司收到国家药品监督管理局下发的《受理通知书》,公司提交的硫酸阿托品滴眼液(HR19034滴眼液)药品上市许可申请获国家药监局受理,申请上市的适应症为:用于延缓等效球镜度数为-0.50D至-4.00D(散光≤1.50D、屈光参差≤1.50D)的6至12岁儿童近视进展。此次申报上市,是基于一项随机、双盲、安慰剂平行对照的Ⅱ/Ⅲ期临床研究(研究编号HR19034-301),研究结果表明,公司阿托品滴眼液(HR19034滴眼液)在主要终点上显著优于对照组,且在儿童近视患者中长期治疗的安全性、耐受性良好。
药物信息
药物名称:Atropine
适应症:延缓6至12岁儿童近视进展
研发公司:恒瑞医药
API结构
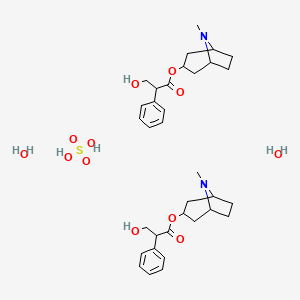
CAS:73791-47-6
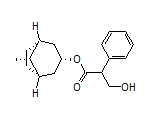
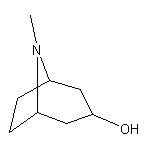
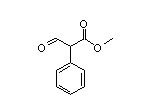
Atropine结构中韶远能够提供的小分子砌块
SY380182
SY005218
SY224848
四、Mirdametinib获FDA批准上市,用于治疗2岁及以上患有不适于完全切除的1型神经纤维瘤病(NF1)月有症状的丛状神经纤维瘤(PN)成人和儿童患者
近日,SpringWorks Therapeutics宣布FDA已批准MEK抑制剂Gomekli(Mirdametinib)上市,用于治疗年龄不低于2岁的1型神经纤维瘤病相关丛状神经纤维瘤(NF1-PN)成人和儿童患者。临床试验结果显示,Mirdametinib达到了ORR的主要终点,成人患者的ORR为41%,儿童患者的ORR为52%。在确认获得缓解的患者中,88%的成人和90%的儿童患者的缓解持续时间至少为12个月,而50%的成人患者和48%的儿童患者的缓解持续时间至少为24个月。
药物信息
药物名称:Mirdametinib
适应症:2岁及以上患有不适于完全切除的1型神经纤维瘤病(NF1)月有症状的丛状神经纤维瘤(PN)成人和儿童
研发公司:SpringWorks Therapeutics
API结构
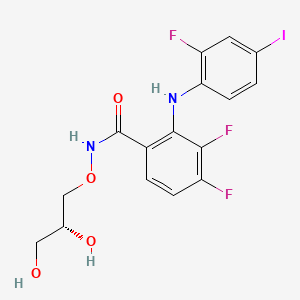
CAS:391210-10-9
Mirdametinib结构中韶远能够提供的小分子砌块
SY394532
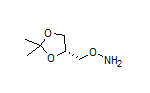
SY105714
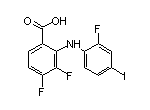
五、FDA已受理Troriluzole用于治疗成人脊髓小脑共济失调症(SCA)的新药申请,并授予优先审评资格。
近日,Biohaven宣布FDA已受理Troriluzole用于治疗成人脊髓小脑共济失调症(SCA)的新药申请,并授予优先审评资格。根据一项RWE研究,经3年治疗后,Troriluzole可将SCA患者的病情进展减缓最高达70%。在Troriluzole治疗组中,SCA患者的疾病进展获得显著且具有临床意义的减缓,治疗带来的益处使得相较于未治疗的患者,病情恶化的速度减慢了50%-70%,在3年的研究期间,疾病进展延缓了1.5至2.2年。
药物信息
药物名称:Troriluzole
适应症:成人脊髓小脑共济失调症(SCA)
研发公司:Biohaven
API结构
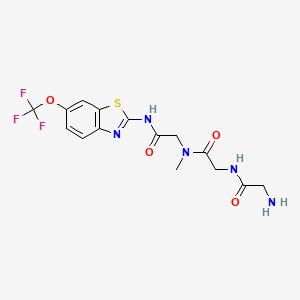
CAS:1926203-09-9
Troriluzole结构中韶远能够提供的小分子砌块
SY028638
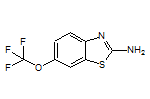
SY032811
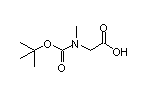
SY002232
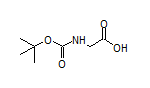
六、InFlectis BioScience宣布其临床IIa期试验P288ALS TRIAL已成功完成
近日,InFlectis BioScience宣布其临床IIa期试验P288ALS TRIAL已成功完成。分析显示,其在研口服小分子疗法IFB-088(Icerguastat)具有良好安全性和耐受性,并展现用以治疗延髓性肌萎缩侧索硬化症(bulbar-onset ALS)的初步潜在疗效。在遵从治疗方案的人群(n=40)中,6个月期间,IFB-088组患者每月平均下降0.95分,而安慰剂组则每月下降1.42分,IFB-088组患者表现出较低的功能衰退趋势。
药物信息
药物名称:Icerguastat
适应症:延髓性肌萎缩侧索硬化症(bulbar-onset ALS)
研发公司:InFlectis BioScience
API结构
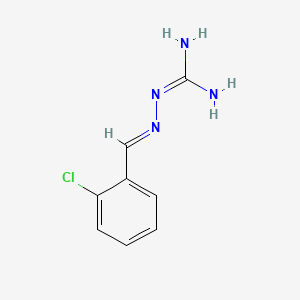
CAS:951441-04-6
Icerguastat结构中韶远能够提供的小分子砌块
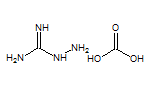
SY001545
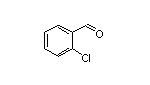
SY016926
素材来源:药渡、Pubchem,若有侵权望联系删除!
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com




