

一、英派药业塞纳帕利胶囊(派舒宁®)获得中国国家药品监督管理局(NMPA)批准上市
南京英派药业有限公司(以下简称"英派药业" ),一家专注于肿瘤合成致死作用机制的创新药研发公司,欣然宣布自主研发的塞纳帕利胶囊(商品名:派舒宁®)已获得国家药品监督管理局(NMPA)批准上市,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
塞纳帕利是由英派药业自主研发的新型、高效的PARP1/2抑制剂,具有独特的分子结构,使其具备体外和体内高活性,以及高靶向选择性和广泛的安全窗口。塞纳帕利的获批是基于FLAMES研究,该研究是一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床研究,旨在评价一线含铂化疗达到完全缓解(CR)或部分缓解(PR)后塞纳帕利单药维持治疗晚期卵巢癌患者的有效性和安全性。FLAMES研究结果显示,塞纳帕利维持治疗能够显著延长晚期卵巢癌患者的中位无进展生存期(mPFS)(未达到 vs 13.6月, HR 0.43, P < 0.0001),且不论患者的BRCA基因表达如何,均能从塞纳帕利治疗中获益。同时,塞纳帕利耐受性良好,安全性可控。[1]此外,塞纳帕利在具有同源重组缺陷(HRD)和同源重组修复正常(HRR)亚组的患者中均显示出显著PFS获益,突显其广泛的临床应用潜力。此研究结果将有力支持塞纳帕利单药作为新诊断卵巢癌患者一线全人群维持治疗的标准方案。
该研究数据于2023年欧洲肿瘤内科学会(ESMO)大会和2024年中国临床肿瘤学会(CSCO)大会等重要学术会议上,通过口头报告的形式展示,并发表在国际顶级医学期刊《Nature Medicine》。
药物信息
药物名称:Senaparib
适应症:晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌
研发公司:英派药业
API结构
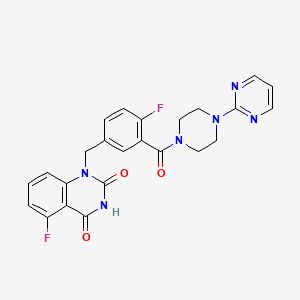
CAS:1401682-78-7
Senaparib结构中韶远能够提供的小分子砌块
SY002612
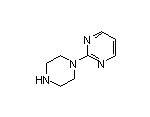
SY016922
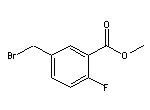
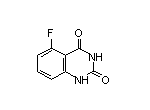
SY011009
二、强势开局!KarXT用于治疗精神分裂症的新药上市申请获国家药监局受理
再鼎医药近日宣布,国家药品监督管理局(NMPA)已受理KarXT用于治疗成人精神分裂症的新药上市申请(NDA)。
再鼎医药总裁,全球研发负责人Rafael Amado博士表示:"中国有超过800万精神分裂症患者,由于目前治疗方案疗效有限且伴有不良副作用,他们面临着巨大的未满足需求。在临床研究中,KarXT显示出具有统计学意义的对精神分裂症症状的减轻效果,且安全性可耐受。如获批,KarXT有可能重新定义这一疾病领域的治疗。"
此项3期临床研究的主要研究者,首都医科大学附属北京安定医院院长王刚教授表示:"这是多年来第一个全新靶点的抗精神病药物,期待早日用于临床,使更多患者获益。"
此次NDA基于中国开展的1期药代动力学(PK)、3期临床研究(ZL-2701-001)研究结果以及全球EMERGENT系列临床研究的数据支持。
中国3期研究达到了主要终点,在第五周时,与安慰剂相比,KarXT的PANSS总分降低了9.2分,具有显著的统计学意义(-16.9 KarXT对比-7.7 安慰剂,p=0.0014)。该研究也达到了所有关键次要疗效终点,在第五周时,与安慰剂相比,PANSS阳性症状分量表评分、PANSS阴性症状分量表评分、PANSS Marder阴性症状因子评分、临床总体印象量表严重程度(CGI-S)评分以及第五周时的PANSS应答者百分比均表现出显著改善。对比KarXT此前的精神分裂症相关研究,该研究中未出现新的或预期外的安全性信号。与全球临床研究结果类似,治疗组中治疗相关的常见不良事件包括呕吐、心动过速、恶心、全身性高血压、头晕和腹泻。
在全球3期EMERGENT-2和EMERGENT-3研究中,KarXT达到了其主要终点,与安慰剂相比,精神分裂症症状具有统计学意义的减轻。KarXT的安全性和耐受性已在急性期和长期临床研究中得到证实。
2024年9月,美国食品药品管理局(FDA)批准 COBENFYTM(呫诺美林曲司氯铵)用于治疗成人精神分裂症。COBENFY没有非典型抗精神病药物的类别警告和注意事项,也没有黑框警告。
药物信息
药物名称:Trospium Chloride
适应症:精神分裂症
研发公司:再鼎医药
API结构
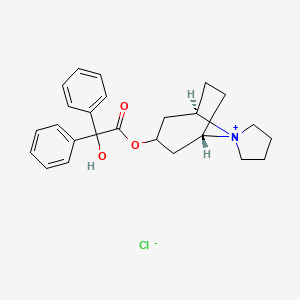
CAS:10405-02-4
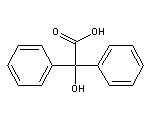
Trospium Chloride结构中韶远能够提供的小分子砌块
SY127833
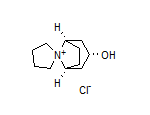
SY014121
三、勃林格殷格翰在研疗法nerandomilast被纳入优先审评,加速惠及中国特发性肺纤维化患者
近日,国家药品监督管理局药品审评中心(CDE)正式授予勃林格殷格翰在研肺纤维化疗法口服磷酸二酯酶4B(PDE4B)抑制剂nerandomilast优先审评审批资格,其拟定适应症为用于治疗成人特发性肺纤维化(Idiopathic Pulmonary Fibrosis, IPF)。这一在研药物有望为IPF患者带来全新的治疗选择,以满足IPF患者巨大的未尽临床之需。
优先审评是国家药品监督管理局药品审评中心(CDE)为鼓励研究和创制新药,满足临床用药需求,加快创新药品审评速度而设置。此次被纳入优先审评将进一步推动该在研创新产品在中国获批的步伐,加速惠及中国IPF患者。
IPF是一种罕见病,于2018年被列入中国国家第一批罕见病目录。研究报告显示,近年来,中国IPF病例不断增多[1],[2],[3]。IPF为一种严重的致死性肺部疾病,特征性的表现为肺纤维化程度持续增加、肺功能持续下降、呼吸症状加重,严重影响患者生活质量。IPF的自然病程多变且无法预测,预后不佳,患者在确诊后的中位生存期约为3年[4]。在现有的疾病管理和治疗下,部分患者最终仍然出现早期死亡[5],[6],[7]。IPF的5年生存率低于多种常见癌症[8]。目前,IPF直接的致病途径尚不明确,治疗手段一直十分有限。
IPF表现为肺泡上皮细胞损伤和随后的修复失调和重塑。Nerandomilast是一款在研的口服PDE4B抑制剂,选择性抑制PDE4B同工酶。在人体中,PDE4B同工酶在肺中高表达,在肺纤维化和炎症中发挥重要作用。预期nerandomilast具有抗纤维化和抗炎双重作用,有望为IPF患者带来临床获益。
药物信息
药物名称:Nerandomilast
适应症:特发性肺纤维化
研发公司:勃林格殷格翰
API结构
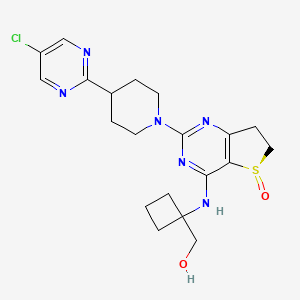
CAS:1423719-30-5
Nerandomilast结构中韶远能够提供的小分子砌块
SY355337
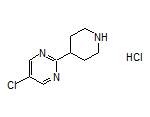
SY098454

SY027784
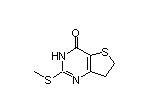
SY028006
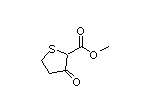
四、优锐医药宣布恩司芬群(Ensifentrine,Ohtuvayre™)在中国澳门特别行政区获批
优锐医药("Nuance Pharma")宣布,恩司芬群(Ensifentrine,Ohtuvayre™)已获得中国澳门特别行政区药物管理局的批准,用于成人慢性阻塞性肺病(COPD)的维持治疗。
2024年6月,恩司芬群(Ensifentrine,Ohtuvayre™)在美国获批,并于2024年8月底在美国商业上市。恩司芬群(Ensifentrine,Ohtuvayre™)是一款全球首创的吸入型磷酸二酯酶3、4双靶点抑制剂(PDE3 & PDE4),双重抑制机理使其能够凭借单个化合物同时实现支气管扩张以及抗炎效应。恩司芬群(Ohtuvayre™)可通过普通雾化器直接递送到肺部,使用简便,不需要复杂的手口协调操作。
恩司芬群(Ensifentrine,Ohtuvayre™)在中国澳门特别行政区的获批基于包括全球三期ENHANCE临床试验在内的广泛数据,其结果发表于《美国呼吸与危重症医学杂志》。在ENHANCE临床试验中,恩司芬群(Ensifentrine,Ohtuvayre™)无论单独使用还是与其他维持疗法联合使用,均显示出临床益处。恩司芬群(Ensifentrine,Ohtuvayre™)在中度至重度COPD患者中耐受性良好。
药物信息
药物名称:Ensifentrine
适应症:慢性阻塞性肺病
研发公司:优锐医药
API结构
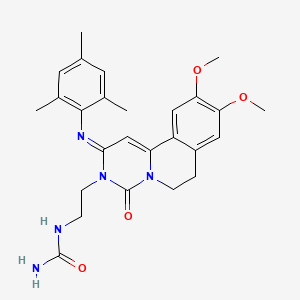
CAS:1884461-72-6
Ensifentrine结构中韶远能够提供的小分子砌块
SY005376
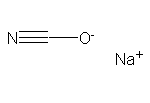
SY002569
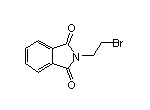
SY020729
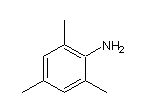
SY297047
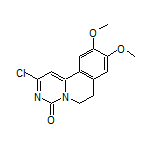
五、默沙东注射用头孢洛生他唑巴坦钠(卓利达®)在华获批 为耐药菌感染治疗带来新选择
默沙东(美国新泽西州罗威市默克公司的公司商号)宣布,其新型酶抑制剂复合制剂——注射用头孢洛生他唑巴坦钠(注册商标:卓利达®)已获得中国国家药品监督管理局批准,适用于与甲硝唑联合治疗成人和儿童(出生至18岁以下)患者由敏感革兰阴性和革兰阳性微生物引起的复杂性腹腔感染(cIAI);治疗成人和儿童(出生至18岁以下)患者由敏感革兰阴性微生物引起的复杂性尿路感染(cUTI)(包括肾盂肾炎);治疗成人(18岁及以上)患者由敏感革兰阴性微生物引起的医院获得性细菌性肺炎(HABP)和呼吸机相关性细菌性肺炎(VABP)。
药物信息
药物名称:Ceftolozane
适应症:耐药菌感染
研发公司:默沙东
API结构
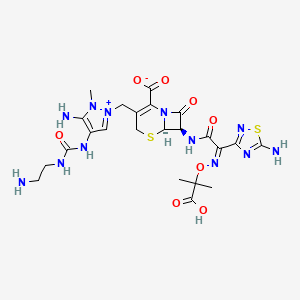
CAS:689293-68-3
Ceftolozane结构中韶远能够提供的小分子砌块
SY275091
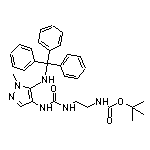
SY034686
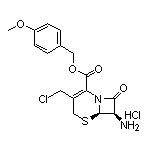
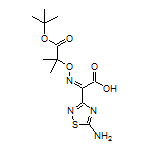
SY291785
六、泰合生技全球首款抗凝剂口溶膜TAH3311关键研究取得积极成果
泰合生技药品股份有限公司(TAHO Pharmaceuticals)宣布,其全球首创的阿哌沙班(Apixaban)口溶膜TAH3311的关键研究取得了积极的初步成果。研究证实,在空腹条件下,TAH3311与美国和欧洲的阿哌沙班参比片剂(艾乐妥®(Eliquis®))具有生物等效性,其Cmax(血药峰浓度)和AUC(药时曲线下面积)值均在监管机构认可的范围(80-125%)内。该研究招募了60名健康的受试者,其中48人完成了试验。研究结果符合此前与美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)讨论的标准,为提交新药申请(NDA)和上市许可申请(MAA)奠定了基础,标志着监管进程中的一个重要里程碑。
全球每年有1500万人罹患中风。近一半的住院中风患者存在吞咽困难的症状,约13%的患者会发展为长期吞咽障碍。对于吞咽困难的患者,常规抗凝剂通常需要将片剂碾碎并与液体混合服用,这可能导致剂量不准确,给患者带来极大不便。TAH3311可在口腔内无需用水快速溶解,是更加便捷的片剂替代方案。泰合生技董事长兼首席执行官李世仁(Howard Lee)博士表示:"这项关键研究彰显了我们以患者为中心、努力打造创新解决方案的承诺。TAH3311为中风患者、老年人、儿童或其他有吞咽困难且每日需口服两次抗凝药的人群带来了福音。我们相信,这种新的药物剂型能够改善患者预后,降低因用水送服药物时呛噎导致吸入性肺炎的风险。"
2024年,美国阿哌沙班销售额达到261亿美元 *,全球抗凝剂市场持续扩大。鉴于这些趋势,TAH3311作为一种更安全、更易服用的治疗方案,具有良好的市场前景。泰合生技计划于2025年第三季度在美国和欧洲提交监管申请。同时,公司正积极寻求与国际合作伙伴建立战略合作,以加速TAH3311的全球上市进程。
药物信息
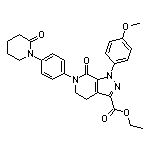
药物名称:Apixaban
适应症:使有吞咽困难且每日需口服两次抗凝药的人群更安全、更易服用
研发公司:泰合生技
API结构
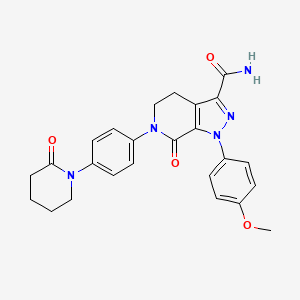
CAS:503612-47-3
Apixaban结构中韶远能够提供的小分子砌块
SY030374
素材来源:药渡、Pubchem,若有侵权望联系删除!
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com




